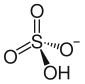
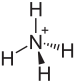Amonyum bisülfat
| |||

| |||

| |||
| Adlandırmalar | |||
|---|---|---|---|
Amonyum hidrojen sülfat | |||
| Tanımlayıcılar | |||
3D model (JSmol)
|
|||
| ChemSpider | |||
| ECHA InfoCard | 100.029.332 | ||
PubChem CID
|
|||
| RTECS numarası |
| ||
| UNII | |||
CompTox Bilgi Panosu (EPA)
|
|||
| |||
| |||
| Özellikler | |||
| Molekül formülü | (NH4)HSO4 | ||
| Molekül kütlesi | 115.11 g/mol | ||
| Görünüm | Kristal Beyaz | ||
| Yoğunluk | 1.78 g/cm3 | ||
| Erime noktası | 147 °C (297 °F; 420 K) | ||
| Çözünürlük (su içinde) | Çok çözünür | ||
| Çözünürlük (başka çözücü içinde) | Metanol'de çözünür Aseton'da çözünmez. | ||
| Tehlikeler | |||
| NFPA 704 (yangın karosu) |
|||
| Güvenlik bilgi formu (SDS) | External MSDS | ||
| Benzeyen bileşikler | |||
Diğer anyonlar
|
Amonyum tiyosülfat Amonyum sülfit Amonyum sülfat Amonyum persülfat | ||
Diğer katyonlar
|
Sodyum bisülfat Potasyum bisülfat | ||
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |||
| Bilgi kutusu kaynakları | |||
Amonyum hidrojen sülfat olarak da bilinen amonyum bisülfat, (NH4) HSO4 formülüne sahip beyaz, kristalimsi bir katıdır. Bu tuz, sülfürik asidin amonyakla yarı nötralizasyonunun ürünüdür.
Üretimi[değiştir | kaynağı değiştir]
Yaygın olarak, ticari kimyasal metil metakrilata giden "aseton siyanohidrin rotası"nın bir yan ürünü olarak toplanır.[1]
Aynı zamanda yüksek saflıkta tuz üreten sülfamik asidin sulu çözelti içinde hidrolizi ile de elde edilebilir:
- H
3NSO
3 + H
2O → (NH
4)HSO
4
Ayrıca amonyum sülfatın termal ayrışmasıyla da ortaya çıkar:
- (NH
4)
2SO
4 → (NH
4)HSO
4 + NH
3
Uygulamaları[değiştir | kaynağı değiştir]
Değerli bir gübre olan amonyum sülfat oluşturmak için amonyakla daha da nötralleştirilebilir. Sodyum bisülfat çok daha yaygın olmasına rağmen, sülfürik asite daha zayıf bir alternatif olarak kullanılabilir.
Doğal oluşumu[değiştir | kaynağı değiştir]
(NH4)3 H(SO4) 2 formülünün ilgili bir bileşiği, kömür yangını ortamlarından bilinen nadir mineral letovisit olarak ortaya çıkar.[2][3]
Kaynakça[değiştir | kaynağı değiştir]
- ^ William Bauer, Jr. "Methacrylic Acid and Derivatives" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a16_441.
- ^ "Letovicite". 15 Nisan 2024 tarihinde kaynağından arşivlendi. Erişim tarihi: 17 Mayıs 2024.
- ^ "List of Minerals". 21 Mart 2011. 15 Mart 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 17 Mayıs 2024.